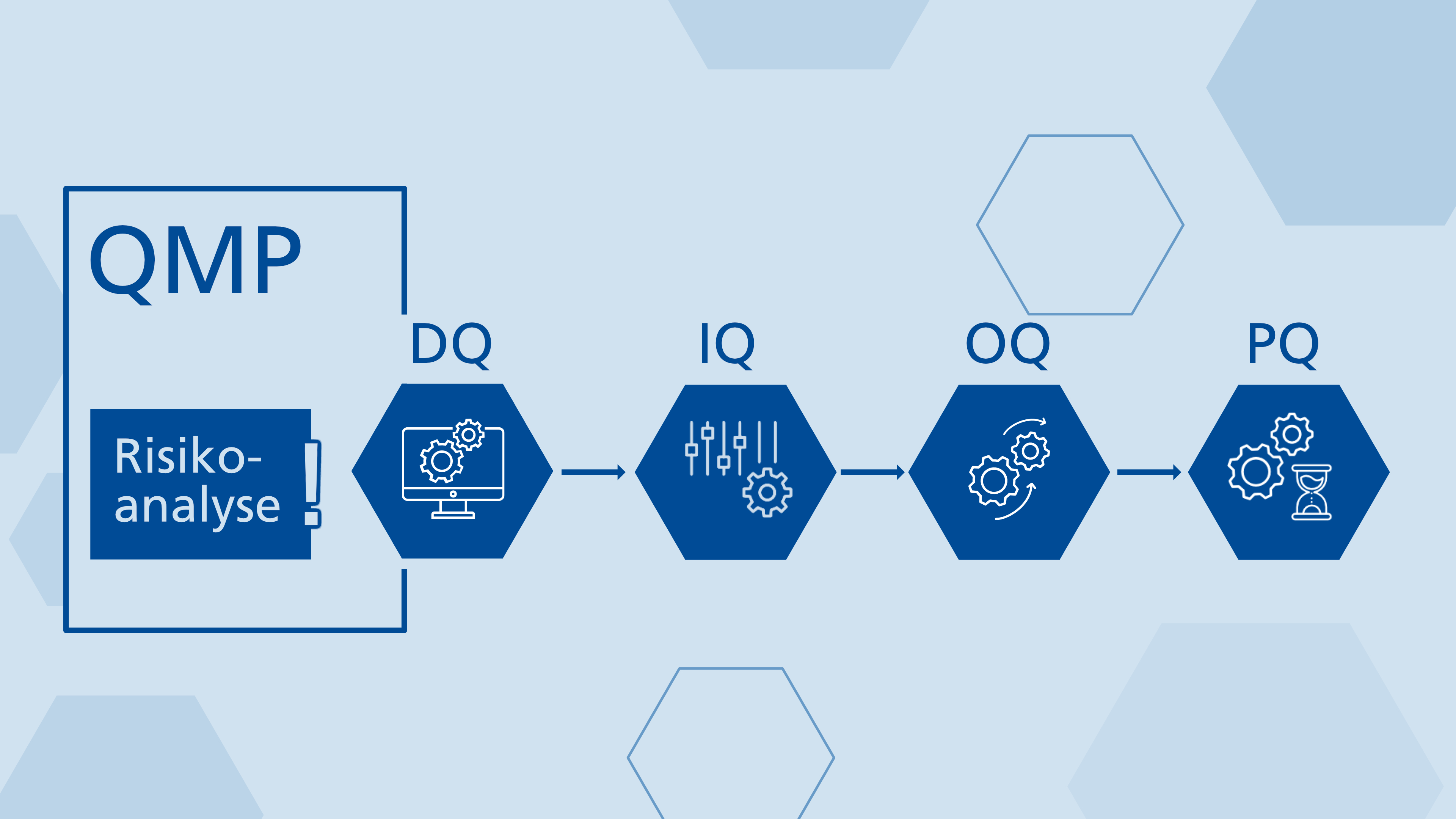
Die GMP-konforme Qualifizierung technischer Systeme ist ein entscheidender Prozess in der pharmazeutischen Industrie, der durch den Qualifizierungsmasterplan (QMP) klar strukturiert wird. In diesem Beitrag analysieren wir den QMP als zentrale Orientierungshilfe, die Verantwortlichkeiten und Abläufe in den Phasen der Designqualifizierung (DQ), Installationsqualifizierung (IQ), Funktionsqualifizierung (OQ) und Leistungsqualifizierung (PQ) definiert. Ein zentrales Element ist die GMP-Risikoanalyse, die nicht nur Risiken identifiziert, sondern auch proaktive Maßnahmen zur Risikominderung entwickelt. Wir diskutieren die kritische Bedeutung einer klaren Abgrenzung der Verantwortlichkeiten zwischen Auftraggeber und Lieferant sowie die Notwendigkeit spezifischer Kompetenzen der Mitarbeiter. Zudem betonen wir die Rolle einer sorgfältigen Dokumentation, um Nachvollziehbarkeit und Compliance zu gewährleisten. Darüber hinaus beleuchten wir die Anforderungen an die Qualifizierung aus Sicht der Behörden.

